Unter innerer Energie U eines Stoffes versteht man die gesamte Energie der N Moleküle im Volumen V. Sie setzt sich zusammen aus potenzieller und kinetischer Energie (Translations-, Rotations- und Schwingungsenergie).
Für die mittlere Energie eines Moleküls gilt: ![]() mit f Freiheitsgrade, k Boltzmann-Konstante.
mit f Freiheitsgrade, k Boltzmann-Konstante.
Für die innere Energie eines Stoffes mit N Molekülen (Stoffmenge
![]() ) erhält
man also
) erhält
man also
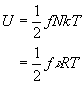
Für die Zahl der Freiheitsgrade gilt
|
Energie |
Anzahl der Freiheitsgrade |
|
|
Translation |
3 |
|
|
Rotation |
nichtlineare Moleküle |
3 |
|
lineare Moleküle |
2 |
|
|
Vibration |
je Molekülschwingung |
2 |
Die Freiheitsgrade eines Moleküls ergeben sich als Summe der Translations-, Rotations- und Vibrationsfreiheitsgrade:
![]()
Damit ergibt sich für ein
|
einatomiges Gas: |
|
3 Translations-Freiheitsgrade |
|
zweiatomiges Gas |
|
3 Translations-Freiheitsgrade |
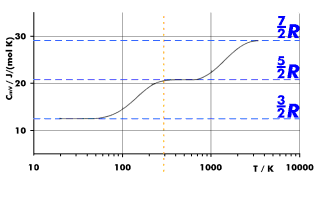 |
| Qualitativer Temperaturverlauf der molaren Wärmekapazität bei konstantem Volumen von Wasserstoff. Die Gleichungen gelten erst bei hohen Temperaturen. |
Wichtig: Dies stimmt nur bei mittleren Temperaturen, etwa bei Zimmertemperatur (siehe Bild)!
![]() Experiment: Freiheitsgrade
Experiment: Freiheitsgrade
© Universität Würzburg, Tilo Hemmert 2000