 |
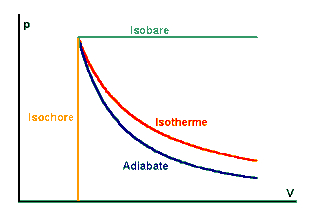
| Übersicht über die vier möglichen Zustandsänderungen |
Graf im p(V)-Diagramm: Isobare parallel zur V-Achse
Bei Isobaren ändert sich der Druck nicht (dp=0) und der erste Hauptsatz lässt sich folgendermaßen schreiben
![]() .
.
Man definiert eine neue Zustandsgröße
![]()
Enthalpie.
Mit ![]() kommt
man für isobare Zustandsänderungen (dp=0) zu dem Ergebnis
kommt
man für isobare Zustandsänderungen (dp=0) zu dem Ergebnis
![]() .
.
Bei isobaren Zustandsänderungen ist die Enthalpiezunahme gleich der zugeführten Wärmemenge.
(Anmerkung: Die Enthalpie spielt eine wichtige Rolle bei Phasenumwandlungen, chemischen Reaktionen mit p=const.)
Damit ergibt sich bei konstantem Druck:
![]()
Wärmekapazität
bei konstantem Druck.
Wie hängen nun bei idealen Gasen die Wärmekapazitäten bei konstantem Druck Cp und bei konstantem Volumen CV zusammen?
Bei konstantem Druck benötigt man Energie zum einen zur Erhöhung
der inneren Energie ![]() und zum anderen um Druckarbeit dW zu leisten:
und zum anderen um Druckarbeit dW zu leisten: ![]() .
.
Es gilt also ![]() und damit
und damit
![]() .
.
© Universität Würzburg, Tilo Hemmert 2000