Man beobachtet, dass sich Gase im Gegensatz zu Festkörpern und Flüssigkeiten expandieren und bis zu einem gewissen Grad auch komprimieren lassen. Die Dichte von Gasen ist bei Atmosphärendruck etwa um drei Größenordnungen kleiner als in der festen und flüssigen Phase.
Makroskopisch beobachtbare Phänomene zeigen den Zusammenhang zwischen Zustandsgrößen eines Gases. In Experimenten kann jeweils eine der Zustandsgrößen Temperatur T, Druck p und Volumen V konstant gehalten werden.
![]() Experiment: Gesetz von Boyle-Mariotte
Experiment: Gesetz von Boyle-Mariotte
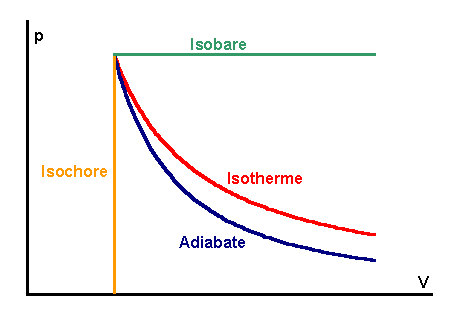 |
| Isotherme, Isobare, Isochore und Adiabate in einem p(V)-Diagramm |
Temperatur T konstant (Isotherme):
![]()
Boyle-Mariotte-Gesetz
![]()
Gay-Lussac-Gesetz
Volumen V konstant (Isochore):
![]()
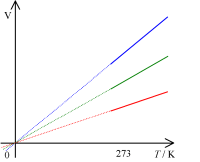 |
| Qualitatives V(T)-Diagramm für unterschiedliche Gase bei konstantem Druck. Extrapolation führt zum absoluten Nullpunkt und damit zur Festlegung der Kelvin-Skala. |
Insgesamt erhält man das Gesetz von Avogadro:
Gleiche Volumina Gas von gleichem Druck und gleicher Temperatur enthalten gleich viele Moleküle unabhängig von ihrer chemischen Beschaffenheit.
![]()
Die Konstante ist proportional zur "Gasmenge" bzw. allgemein
zur Stoffmenge ![]() .
.
![]()
Gesetz von Avogadro
Dabei bezeichnet R die allgemeine Gaskonstante ![]() und
und
![]() die Stoffmenge
des Gases. Das Gesetz gilt für ideale Gase. Reale Gase erfüllen es
um so besser, je höher die Temperatur und je geringer der Druck ist.
die Stoffmenge
des Gases. Das Gesetz gilt für ideale Gase. Reale Gase erfüllen es
um so besser, je höher die Temperatur und je geringer der Druck ist.
© Universität Würzburg, Tilo Hemmert 2000