 |
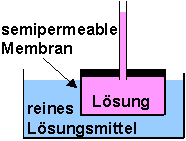
Bei den bisher studierten Beispielen, konnten Teilchen in jede Richtung (in bzw. aus dem porösen Tonzylinder) wandern. Nun betrachten wir ein Lösung (z.B. konzentrierte Kupfersulfatlösung), die durch eine semipermeable Membran von einem Lösungsmittel (z.B. Wasser) getrennt ist. Durch die Membran können Wasserteilchen in das Gebiet der konzentrierten CuSO4-Lösung diffundieren, umgekehrt gelangen aber keine CuSO4-Teilchen in das Lösungsmittel.
Der Konzentrationsunterschied kann also nicht durch Diffusion des gelösten Stoffs (CuSO4) ausgeglichen werden. Da aber das Lösungsmittel (Wasser) in das Volumen des gelösten Stoffs diffundieren kann, erfolgt dort eine Konzentrationsabsenkung.
Unter Osmose versteht man die Nettodiffusion, die durch den Konzentrationsgradienten bedingt ist.
Durch die Osmose baut sich im Gebiet des gelösten Stoffes ein Druck auf, der proportional zur Konzentration des gelösten Stoffes ist. Diesen Druck nennt man osmotischen Druck. Experimentell findet man (analog dem idealen Gas):
![]()
van’t Hoff’sches Gesetz
Dabei ist ![]() die Stoffmenge des gelösten Stoffes im Volumen V der Lösung.
die Stoffmenge des gelösten Stoffes im Volumen V der Lösung.
© Universität Würzburg, Tilo Hemmert 2000