 |
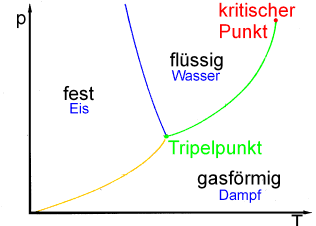
| Qualitatives Phasendiagramm von Wasser. Oberhalb der Dampfdruckkurve liegt die flüssige Phase vor. Die Sublimationskurve trennt die feste und die gasförmige Phase. Beachten Sie die negative Steigung (Anomalie des Wassers!) der Schmelzkurve, die den Übergang von fester in die flüssige Phase kennzeichnet. |
Stoffe können in verschiedenen Aggregatszuständen vorliegen: fest, flüssig, gasförmig. Diese Zustände nennt man auch Phasen. Bei Änderung von Druck p, Volumen V oder Temperatur T können Phasenübergänge stattfinden. Ein Stoff kann auch gleichzeitig in mehreren Phasen vorkommen, vgl. Koexistenzgebiete bei realen Gasen.
Die Teilchendichte in Gasen ist etwa 1000 mal kleiner als in Festkörpern oder Flüssigkeiten. Daher sind Gase kompressibel. Dagegen lassen sich Festkörper und Flüssigkeiten deutlich schwerer komprimieren (vgl. steilen Anstieg im p(V)-Diagramm bei realen Gasen nach dem Koexistenzbereich flüssig-gasförmig).
An diesem Punkt liegen alle drei Phasen im Gleichgewicht vor.
© Universität Würzburg, Tilo Hemmert 2000