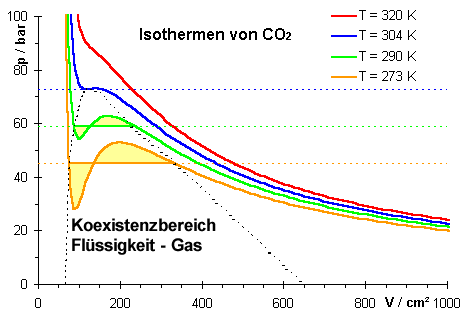
Analog zur Maxwellschen-Geschwindigkeitsverteilung in Gasen gibt es in Flüssigkeiten einige Moleküle, die eine deutlich höhere kinetische Energie als der statistische Mittelwert besitzen. Diese Moleküle können die anziehenden Kräfte an der Oberfläche der Flüssigkeit überwinden. In einem abgeschlossenen Raum stellt sich über der Flüssigkeitsoberfläche ein Sättigungsdampfdruck ps ein. Es treten genauso viele Moleküle aus der Flüssigkeit aus (verdampfen), wie in die Flüssigkeit ein (kondensieren). Der Dampfdruck ist nur abhängig von der Temperatur nicht aber vom Volumen.
 |
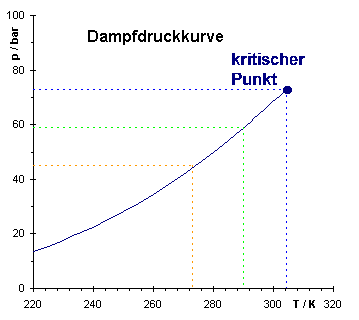 |
| Zusammenhang zwischen p(V)-Diagramm und p(T)-Diagramm. Der Sättigungsdampfdruck ist nur von der Temperatur abhängig, nicht vom Volumen. | |
Der Sättigungsdampfdruck wächst mit zunehmender Temperatur T, wie folgende Gleichung zeigt:
![]()
van’t-Hoff’sche-Gleichung.
Dabei ist ![]() die Verdampfungswärme und
die Verdampfungswärme und ![]() .
.
![]() Experiment: Dampfdruck von Wasser und Ethanol
Experiment: Dampfdruck von Wasser und Ethanol
© Universität Würzburg, Tilo Hemmert 2000