Bei Temperaturen unterhalb des kritischen Punktes können Gase direkt durch Kompression verflüssigt werden. Bei Raumtemperatur zum Beispiel Ammoniak, Kohlendioxid, Wasserdampf.
In allen anderen Fällen (bei höheren Temperaturen) muss das Gas zunächst unter die kritische Temperatur Tk gebracht werden.
Bei der adiabatischen Expansion wird keine Wärme mit der Umgebung ausgetauscht, dQ=0. Durch die Vergrößerung des Volumens nimmt der mittlere Abstand der Teilchen zu. Die dabei aufgebrachte Arbeit gegen die anziehenden Wechselwirkungskräfte der Gasteilchen steigert die potenzielle Energie des Systems und verringert gleichzeitig die kinetische Energie der Teilchen, da kein Energieaustausch mit der Umgebung stattfindet. Das Gas kühlt ab. Dies nennt man den Joule-Thomson-Effekt.
Da Arbeit nach außen abgegeben wird (dW<0), sinkt die innere
Energie des Gases dU<0. Im einfachen Fall des idealen Gases gilt der
ersten Hauptsatz der Thermodynamik: ![]() und damit gilt für die Temperaturabsenkung
und damit gilt für die Temperaturabsenkung
![]() .
.
Eine Temperaturabsenkung ist sowohl für ideale als auch für reale Gase möglich.
Bei realem Gas gilt für die Temperaturänderung
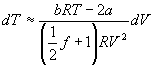 .
.
Dabei sind a und b die Stoffkonstanten aus der van-der-Waals-Gleichung, R die allgemeine Gaskonstante und f die Zahl der Freiheitsgrade.
Um die Gleichung herzuleiten32, lässt man ein reales Gas vom Volumen V1 bei konstantem Druck p1 adiabatisch durch ein Drosselventil in ein Volumen V2 mit kleinerem, konstantem Druck p2< p1 expandieren.
Eine Abkühlung ist bei realen Gasen aber nicht immer möglich. Für dT=0 erhält man
![]()
Inversionstemperatur.
Die Inversionstemperatur TI hängt von den Wechselwirkungskräften und dem Eigenvolumen der Gasteilchen ab.
Bei Temperaturen T<TI unterhalb der Inversionstemperatur ist die Temperaturänderung dT<0, d.h. das Gas kühlt ab.
Oberhalb der Inversionstemperatur erwärmt sich das Gas.
![]() Experiment: Verflüssigung von Luft
Experiment: Verflüssigung von Luft
32 siehe Demtröder (1998, Kap. 10.4.2c, S. 325)
© Universität Würzburg, Tilo Hemmert 2000